Mapa Mental sobre Termodinâmica: Conceitos Fundamentais e Leis

Transcrição do Mapa Mental sobre Trabalho (w)
Parte da física que estuda as leis que regem as relações entre calor, trabalho e outras formas de energia mais especificamente a transformação de energia em outra e a disponibilidade de energia para realização de trabalho e a direção das trocas de calor.
w = F.d
constante
P.A.d
isobárica
w = p.∆v
w ↔ ∆v
∆v > 0 → expansão → w > 0 → pelo gás
∆v < 0 → contração → w < 0 → sobre o gás
∆v = 0 → isocórica → w = 0
Continue lendo…
Calor (Q)
Q > 0 → calor recebido
Q < 0 → calor cedido
Q = 0 → sistema isolado
Transformação adiabática:
→ instantânea
→ sem troca de calor com o meio externo
Transformações:
Isobárica: pressão constante
Isométrica ou Isocórica: volume constante
Isotérmica: temperatura constante
Energia Interna
Somatório de todas as energias moleculares de um gás
Monoatômico: U = 3/2.n.R.T
Gases Perfeitos
Clapeyron
P.V = n.R.T
P = Pressão
V = Volume
n = mol
T = Temperatura
R = constante universal
P = F/A
R = 0,082 atm.L/mol.K
Pa (Pascal)
R = 8,31 Pa.m³/mol.K
1atm = 10⁵ Pa = 1,01325
Mapa Mental sobre Termodinâmica com Leis e Fórmulas
Transcrição do Mapa Mental sobre Termodinâmica
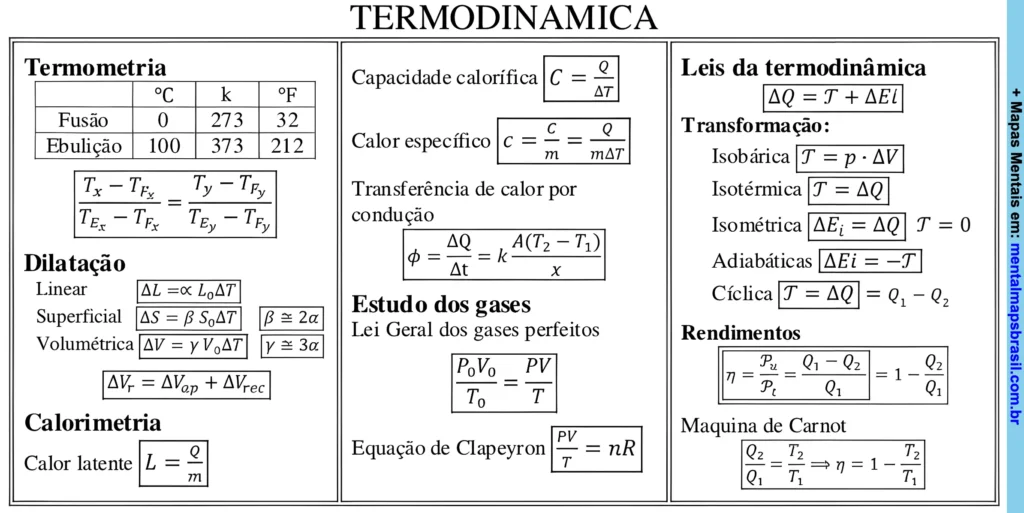
Termometria
| Temperatura | °C | K | °F |
|---|---|---|---|
| Fusão | 0 | 273 | 32 |
| Ebulição | 100 | 373 | 212 |
Dilatação
Linear: ΔL = α L₀ ΔT
Superficial: ΔS = β S₀ ΔT
Volumétrica: ΔV = γ V₀ ΔT
β ≅ 2α
γ ≅ 3α
ΔVr = ΔVap + ΔVrec
Calorimetria
Calor Latente: L = Q/m
Capacidade calorífica
C = Q/ΔT
Continue lendo…
Calor específico
c = Q/(mΔT)
Transferência de calor por condução
ϕ = ΔQ/Δt = k A (T₂ – T₁)/x
Estudo dos gases
Lei Geral dos gases perfeitos: P₀V₀/T₀ = PV/T
Equação de Clapeyron: PV/T = nR
Leis da Termodinâmica
ΔQ = T + ΔEl
Transformação:
Isobárica: T = p · ΔV
Isotérmica: T = ΔQ
Isométrica: ΔEi = ΔQ, T = 0
Adiabáticas: ΔEi = -T
Cíclica: T = ΔQ = Q1 – Q2
Rendimentos
η = Pu/Pt = (Q1 – Q2)/Q1 = 1 – Q2/Q1
Máquina de Carnot
Q2/Q1 = T2/T1 ⇒ η = 1 – T2/T1
Mapa Mental sobre Termodinâmica e Suas Leis
Transcrição do Mapa Mental sobre Termodinâmica
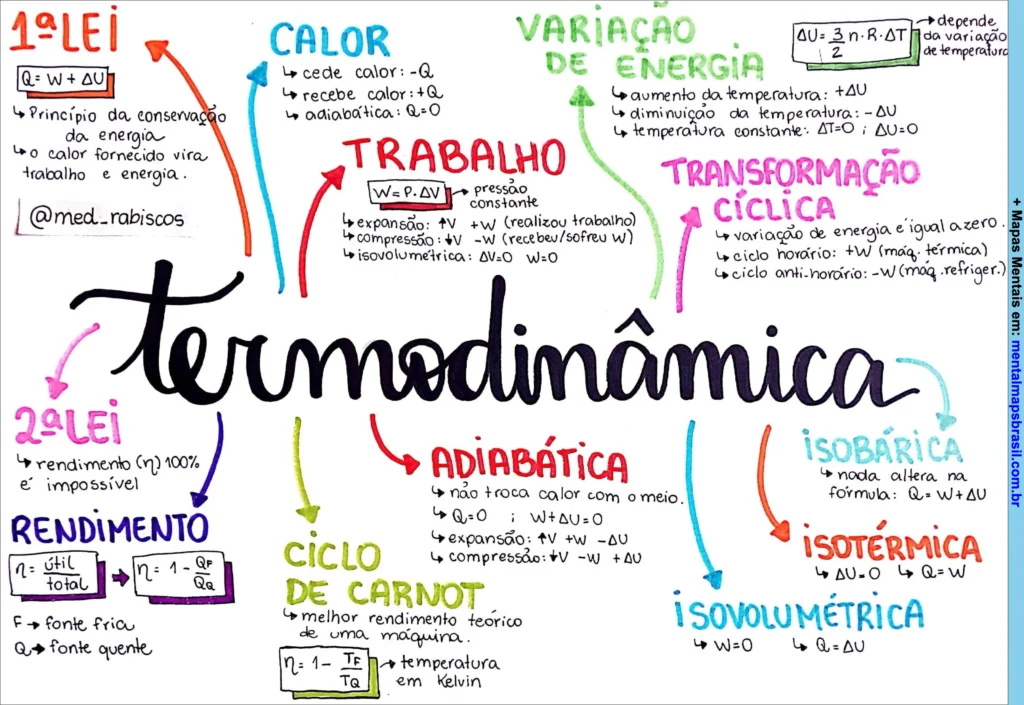
1ª Lei:
- Q = W + ΔU
- Princípio da conservação da energia
- O calor fornecido vira trabalho e energia.
Calor:
- Cede calor: -Q
- Recebe calor: +Q
- Adiabática: Q = 0
Continue lendo…
Trabalho:
- W = P . ΔV
- Expansão: +W
- Compressão: -W
- Isovolumétrica: W = 0
Variação de Energia:
- Aumento da temperatura: +ΔU
- Diminuição da temperatura: -ΔU
- Temperatura constante: ΔT = 0; ΔU = 0
Transformação Cíclica:
- Variação de energia é igual a zero
- Ciclo horário: +W (máq. térmica)
- Ciclo anti-horário: -W (máq. refriger.)
2ª Lei:
- Rendimento (η) 100% é impossível
- η = útil/total
- Qf = fonte fria
- Qq = fonte quente
Ciclo de Carnot:
- Melhor rendimento teórico de uma máquina.
- η = 1 – Tf/Tq
- Temperatura em Kelvin
Adiabática:
- Não troca calor com o meio.
- Q = 0
- W + ΔU = 0
- Expansão: +W → -ΔU
- Compressão: -W → +ΔU
Isobárica:
- Nada altera na fórmula: Q = W + ΔU
Isotérmica:
- ΔU = 0
- Q = W
Isovolumétrica:
- W = 0
Mapa Mental sobre Termodinâmica com Leis e Transformações
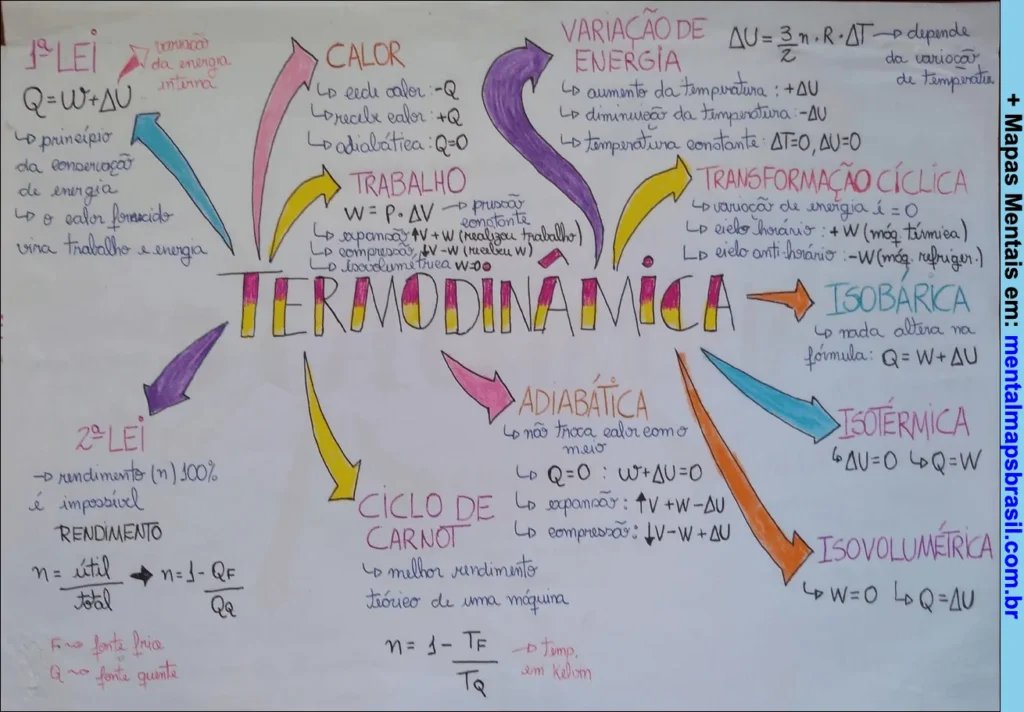
Transcrição do Mapa Mental sobre Termodinâmica
- 1ª Lei
- Q = W + ΔU
- Princípio da conservação de energia.
- O calor fornecido vira trabalho e energia.
2ª Lei
- O rendimento (η) 100% é impossível.
- Rendimento:
- η = útil / total
- η = 1 – Qf / Qq
Continue lendo…
Calor
- Cedê calor: Q
- Recebe calor: +Q
- Adiabática: Q = 0
Trabalho
- W = P . ΔV
- Expansão: +W
- Compressão: -W
- Neleu: W = 0 (isovolumétrica).
Variação de Energia
- Aumento da temperatura: +ΔU
- Diminuição da temperatura: -ΔU
- Temperatura constante: ΔT = 0, ΔU = 0
Transformação Cíclica
- Variação de energia: ΔU = 0
- Ciclo horário = W (máq. térmica).
- Ciclo anti-horário = -W (máq. refrigeração).
Ciclo de Carnot
- Melhor rendimento teórico de uma máquina.
- η = 1 – Tf/Tq
- Tf = temp. em Kelvin (fria).
- Tq = temp. em Kelvin (quente).
Adiabática
- Não troca calor com o meio.
- Q = 0
- U: ΔU + W = 0
- Expansão: +W → -ΔU
- Compressão: -W → +ΔU
Isobárica
- P não altera na fórmula: Q = W + ΔU
Isotérmica
- ΔU = 0, Q = W
Isovolumétrica
- W = 0, ΔQ = ΔU
Mapa Mental sobre Primeira Lei da Termodinâmica: Conceitos e Fórmulas

Transcrição do Mapa Mental sobre 1ª Lei da Termodinâmica
Conceito
Não se perde ou ganha energia em um sistema só se transforma
(Princípio da Conservação de energia)
Calor
Transferência de energia, resultante da diferença de temperatura entre dois sistemas.
Q>0 → calor entra
Q<0 → calor sai
Fórmulas
Q = ∆U + W
U = 3/2 . mRT
PV = mRT
P₁.V₁/T₁ = P₀.V₀/T₀
Continue lendo…
Q = calor
∆U = variação de energia interna
W = trabalho
U = energia interna
m = massa
T = temperatura
P = pressão
V = volume
R = constante dos gases ideais
Unidades mais comuns
Q = kcal/J/cal/kcal
∆U = J/cal
W = J
U = J/cal
T = °C
P = atm
V = L
R = 0,082 atm.L/mol.K
0,082 atm.L/mol.K
Energia Interna ∆U
energia total de um sistema
Conversão de temperatura
°C/5 = °K-273/5 = °F-32/9
Mapa Mental sobre a 2ª Lei da Termodinâmica com Máquinas Térmicas e Entropia
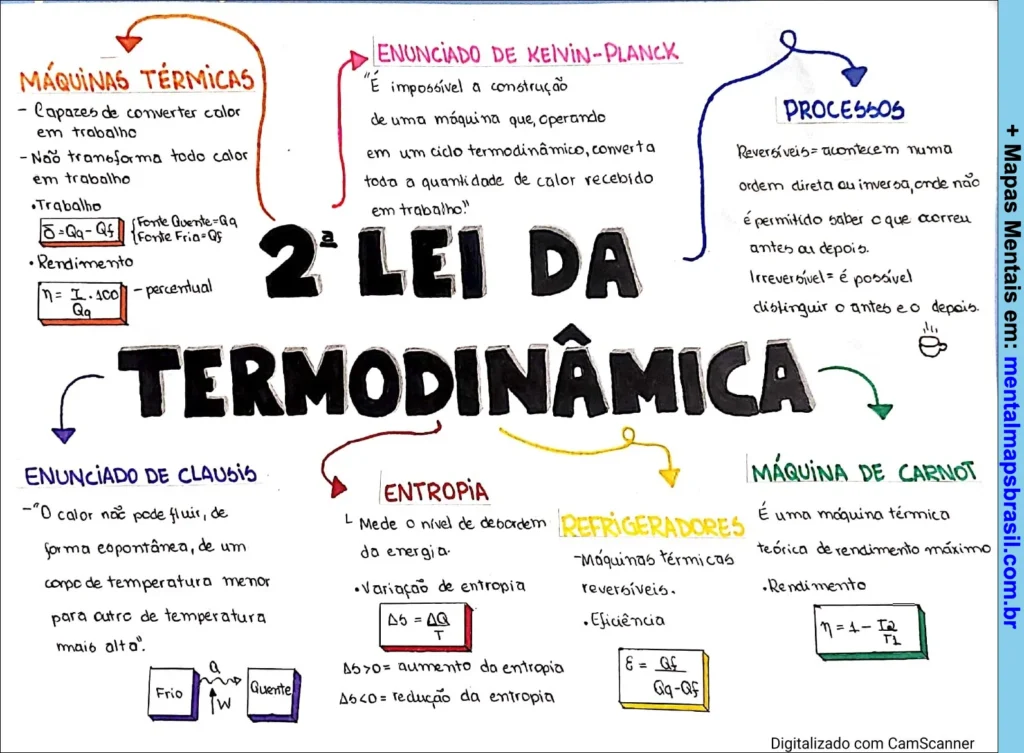
Transcrição do Mapa Mental sobre 2ª Lei da Termodinâmica
Máquinas Térmicas:
- Capazes de converter calor em trabalho.
- Não transforma todo calor em trabalho.
- Trabalho: Δ = Qq – Qf.
- Fonte Quente = Qq. Fonte Fria = Qf.
- Rendimento:
- η = W/Qq x 100. Percentual.
Enunciado de Kelvin-Planck:
- “É impossível a construção de uma máquina que, operando em um ciclo termodinâmico, converta toda a quantidade de calor recebido em trabalho.”
Continue lendo…
- Enunciado de Clausius:
- “O calor não pode fluir, de forma espontânea, de um corpo de temperatura menor para outro de temperatura mais alto.”
- [Ilustração de fluxo de calor de frio para quente].
- Entropia:
- Mede o nível de degradação da energia.
- Variação de entropia:
- ΔS = ΔQ/T.
- ΔS > 0: aumento da entropia.
- ΔS < 0: redução da entropia.
- Processos:
- Reversíveis: acontecem numa ordem direta ou inversa, onde não é permitido saber o que ocorreu antes ou depois.
- Irreversível: é possível distinguir o antes e o depois.
- Refrigeradores:
- Máquinas térmicas reversíveis.
- Eficiência:
- ε = Qf / (Qq – Qf).
- Máquina de Carnot:
- É uma máquina térmica teórica de rendimento máximo.
- Rendimento:
- η = 1 – T2/T1.