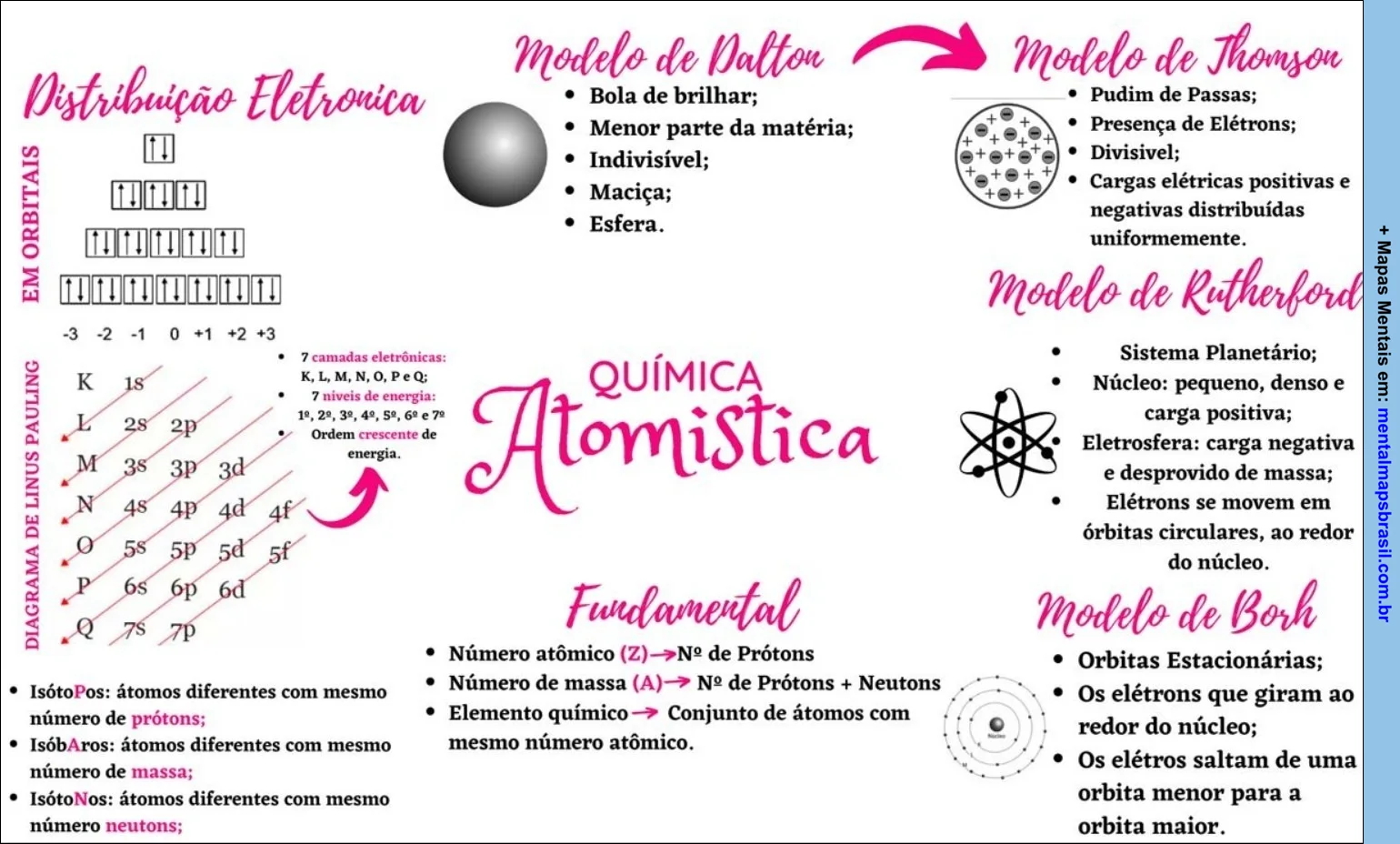
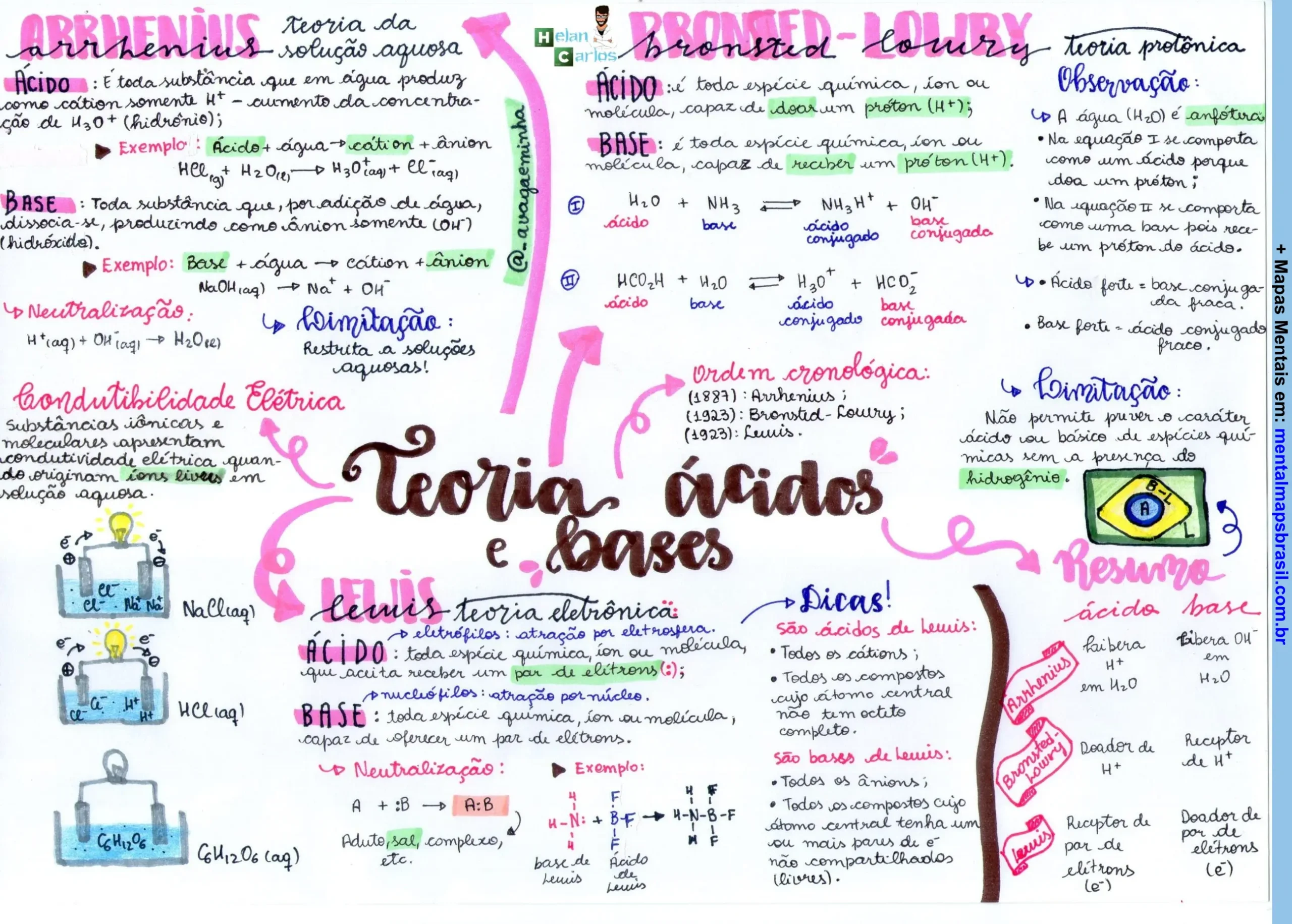
Química do Detergente Mapas Mentais
Mapa Mental sobre a Química do Detergente e suas Propriedades Transcrição do Mapa Mental sobre A química do detergentePorque a água não consegue retirar a gordura das roupas e pratos? Nesse mapa será informado como os detergentes funcionam e suas características. Compartilhe: