Mapa Mental sobre a Teoria Ácido-Base
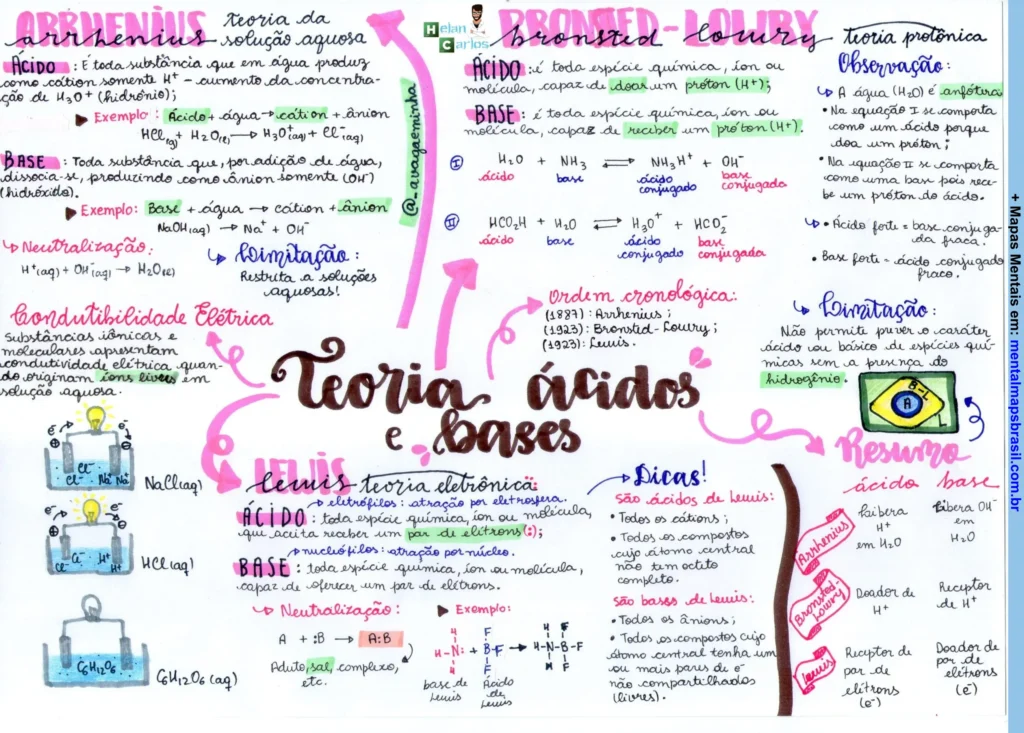
Transcrição do Mapa Mental sobre Teorias de Ácidos e Bases
Arrhenius
Exemplo: NaOH → Na⁺ + OH⁻
Ácido: Toda substância que em solução aquosa pode ceder íons H⁺ (hidrogênio).
Exemplo: HCl → H⁺ + Cl⁻
Base: Toda substância que em solução aquosa pode ceder íons OH⁻ (hidróxido).
Continue lendo…
Bronsted-Lowry
- Ácido: Toda espécie química, íon ou molécula, capaz de doar um próton (H⁺).
- Base: Toda espécie química, íon ou molécula, capaz de receber um próton (H⁺).
- Exemplo: NH₃ + H₂O ⇌ NH₄⁺ + OH⁻
Observações:
- A água (H₂O) é anfótera.
- Na reação I, o ácido e a base se comportam como um par de ácido-base conjugados.
Teoria de Lewis
- Ácido: Espécie atratora de elétrons.
- Base: Espécie doadora de elétrons.
- Exemplo: BF₃ + F⁻ → BF₄⁻
Neutralização:
- A + B → A:B
Dicas:
- Ácidos de Lewis: Todos os cátions e compostos que aceitam pares de elétrons.
- Bases de Lewis: Todos os ânions e moléculas que doam pares de elétrons.
Resumo:
- Ácido: Doa H⁺
- Base: Recebe H⁺
- Arrhenius: Doa H⁺ em H₂O
- Bronsted-Lowry: Doa H⁺
- Lewis: Doador de elétrons
Ordem Cronológica:
(1923) Lewis
(1887) Arrhenius
(1923) Bronsted-Lowry
Infográfico e Fórmulas das Teorias Ácido Base

Transcrição do Mapa Mental sobre TEORIAS ÁCIDO BASE
Teoria de Arrhenius
Ácido
Libera H3O+ em H2O
HCl H2O→ H3O+ + Cl-
Ionização
Base
Libera OH- em H2O
NaOH H2O→ Na+ + OH-
Dissociação iônica
Continue lendo…
Restrições
Ácido deve ter H+
Base deve ter OH-
Meio Aquoso
Teoria de Bronsted Lowry
Ácido
Doador de H+
Base
Receptora de H+
Direto ← Reação → Inverso
Reversível
NH3 + HCl ⇄ NH4+ + Cl-
Base Ácido Ácido Base
↑ Par conjugado ↑
Br.L (H+) | Lewis(Pareto)
Ácido | DOA | RECEBE
Base | RECEBE | DOA
Teoria de Lewis
Ácido
Recebe par de Elétrons, por lig. covalente dativa
Base
Doa par de elétrons por lig. covalente dativa
NH3 + Ag → Ag-NH3
Base Ácido