Mapa Mental sobre Soluções Químicas com definições, classificações e fórmulas

Transcrição do Mapa Mental sobre Soluções
Soluções são sistemas homogêneos formados pela mistura de duas ou mais substâncias. Os componentes de uma solução são denominados de soluto e solvente.
CLASSIFICAÇÕES
Quantidade de soluto
De acordo com a quantidade de soluto que possuem, as soluções químicas podem ser:
• Soluções saturadas: solução com a quantidade máxima de soluto dissolvido pelo solvente. Se mais soluto for acrescentado, o excesso acumula-se formando um corpo de fundo.
• Soluções insaturadas: contém menor quantidade de soluto.
• Soluções supersaturadas: são soluções instáveis e contém uma quantidade de soluto superior à solubilidade.
Continue lendo…
Estado físico
• Soluções sólidas: formadas por solutos e solventes em estado sólido. Por exemplo, a união de cobre e níquel, que forma uma liga metálica.
• Soluções líquidas: formadas por solventes em estado líquido e solutos que podem estar em estado sólido, líquido ou gasoso. Por exemplo, o sal dissolvido em água.
• Soluções gasosas: formadas por solutos e solventes em estado gasoso. Por exemplo, o ar atmosférico.
Natureza do soluto
• Soluções moleculares: quando as partículas dispersas na solução são moléculas, por exemplo, o açúcar (molécula C12H22O11).
• Soluções iônicas: quando as partículas dispersas na solução são íons, por exemplo, o sal comum cloreto de sódio (NaCl), formado pelos íons Na+ e Cl-.
Coeficiente de solubilidade
Representa a capacidade máxima do soluto de se dissolver em uma determinada quantidade de solvente. Isso conforme as condições de temperatura e pressão.
• Soluções diluídas: a quantidade de soluto é menor em relação ao solvente.
• Soluções concentradas: a quantidade de soluto é maior que a de solvente.
Fórmulas
Para calcular o coeficiente de solubilidade e concentração de soluções é utilizada as respectivas fórmula:
cs = 100 * m1 / m2
c = m / V
Mapa Mental sobre Soluções Químicas com classificação e concentração

Transcrição do Mapa Mental sobre soluções Químicas
Mistura homogênea formada por dois ou mais componentes
classificação
INSATURADA: soluto abaixo do coeficiente de solubilidade.
SATURADA: soluto é = ao coeficiente de solubilidade
SUPERSATURADA: a quant. de soluto supera o limite
dispersão
pequenas partículas dispersas de uma substância distribuídas uniformemente em toda extensão de outra substância.
Continue lendo…
SOLUÇÕES COLOIDES SUSPENSÕES
0 1 nm 1000 nm
1nm (nanômetro) = 10^-9 m
CONCENTRAÇÃO comum (c)
C = mₐ / V
massa do soluto
volume da solução
CONCENTRAÇÃO molar (m)
m = nₐ / V = mₐ / Mₐ·V
n° de mol do soluto
volume da solução (L)
massa molar do soluto
densidade (d)
d = m / V
título (T)
em massa: Tₘ = m₁ / m x % em massa do soluto
em volume: Tᵥ = V₁ / V x % em volume do soluto
Mapa Mental sobre Soluções Químicas e seus Tipos de Saturação
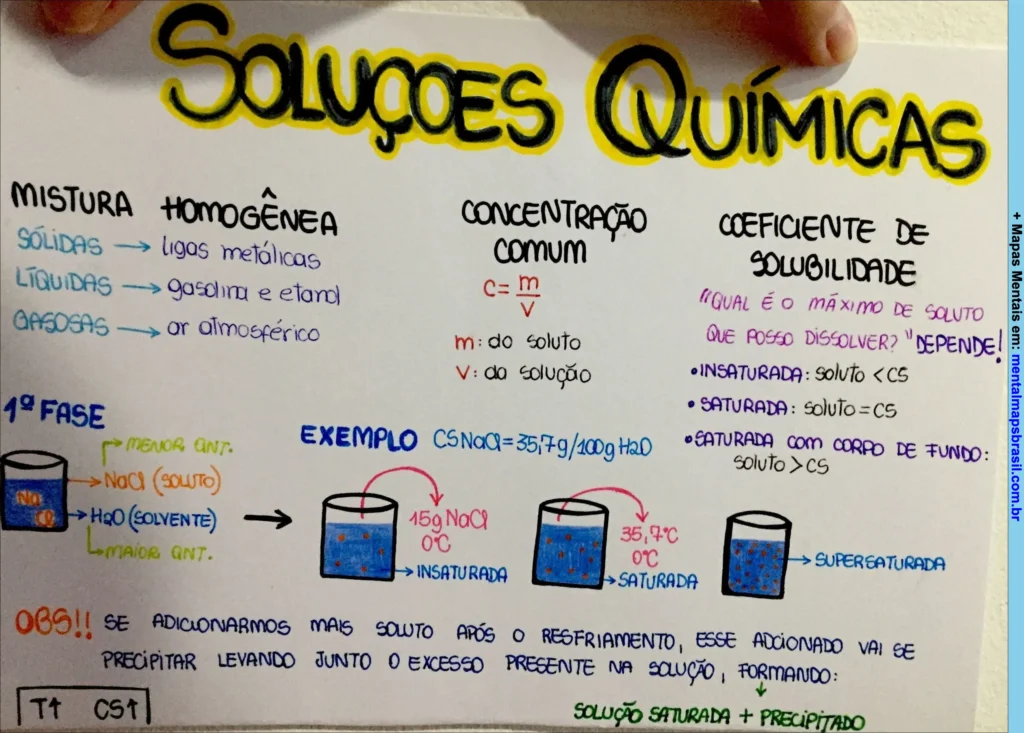
Transcrição do Mapa Mental sobre Soluções Químicas
Mistura Homogênea
Sólidas → ligas metálicas
Líquidas → gasolina e etanol
Gasosas → ar atmosférico
Concentração comum
c = m / V
m: do soluto
V: da solução
Continue lendo…
Coeficiente de solubilidade
“Qual é o máximo de soluto que posso dissolver?” Depende!
• Insaturada: soluto < CS
• Saturada: soluto = CS
• Saturada com corpo de fundo: soluto > CS
1ª fase
NaCl (soluto)
H2O (solvente)
Menor qnt.
Maior qnt.
Exemplo CS NaCl = 35,7g/100g H2O
15g NaCl 0°C → Insaturada
35,7g NaCl 0°C → Saturada
Supersaturada
Obs!! Se adicionarmos mais soluto após o resfriamento, esse adicionado vai se precipitar levando junto o excesso presente na solução, formando:
Solução saturada + precipitado