Mapa Mental sobre Soluções Químicas e Solubilidade com conceitos e gráficos
Transcrição do Mapa Mental sobre Soluções e Solubilidade
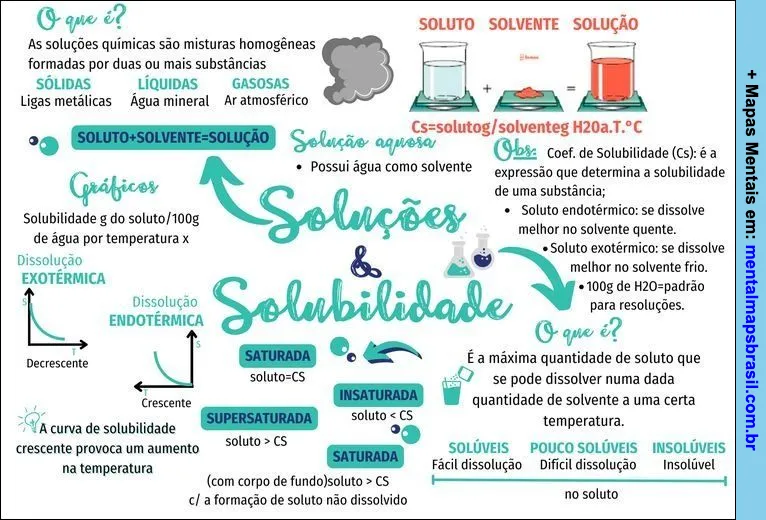
O que é?
As soluções químicas são misturas homogêneas formadas por duas ou mais substâncias
SÓLIDAS
Ligas metálicas
LÍQUIDAS
Água mineral
GASOSAS
Ar atmosférico
SOLUTO + SOLVENTE = SOLUÇÃO
Solução aquosa
- Possui água como solvente
Continue lendo…
Gráficos
Solubilidade g do soluto/100g de água por temperatura x
Dissolução EXOTÉRMICA
(Gráfico decrescente)
Dissolução ENDOTÉRMICA
(Gráfico crescente)
A curva de solubilidade crescente provoca um aumento na temperatura
SATURADA
soluto = CS
SUPERSATURADA
soluto > CS
(com corpo de fundo) soluto > CS c/ a formação de soluto não dissolvido
INSATURADA
soluto < CS
Obs:
Coef. de Solubilidade (CS): é a expressão que determina a solubilidade de uma substância;
• Soluto endotérmico: se dissolve melhor no solvente quente.
• Soluto exotérmico: se dissolve melhor no solvente frio.
• 100g de H2O = padrão para resoluções.
O que é?
É a máxima quantidade de soluto que se pode dissolver numa dada quantidade de solvente a uma certa temperatura.
SOLÚVEIS
Fácil dissolução
POUCO SOLÚVEIS
Difícil dissolução
INSOLÚVEIS
Insolúvel
no soluto
Mapa Mental sobre Soluções Químicas com definições, classificações e fórmulas

Transcrição do Mapa Mental sobre Soluções
Soluções são sistemas homogêneos formados pela mistura de duas ou mais substâncias. Os componentes de uma solução são denominados de soluto e solvente.
CLASSIFICAÇÕES
Quantidade de soluto
De acordo com a quantidade de soluto que possuem, as soluções químicas podem ser:
• Soluções saturadas: solução com a quantidade máxima de soluto dissolvido pelo solvente. Se mais soluto for acrescentado, o excesso acumula-se formando um corpo de fundo.
• Soluções insaturadas: contém menor quantidade de soluto.
• Soluções supersaturadas: são soluções instáveis e contém uma quantidade de soluto superior à solubilidade.
Continue lendo…
Estado físico
• Soluções sólidas: formadas por solutos e solventes em estado sólido. Por exemplo, a união de cobre e níquel, que forma uma liga metálica.
• Soluções líquidas: formadas por solventes em estado líquido e solutos que podem estar em estado sólido, líquido ou gasoso. Por exemplo, o sal dissolvido em água.
• Soluções gasosas: formadas por solutos e solventes em estado gasoso. Por exemplo, o ar atmosférico.
Natureza do soluto
• Soluções moleculares: quando as partículas dispersas na solução são moléculas, por exemplo, o açúcar (molécula C12H22O11).
• Soluções iônicas: quando as partículas dispersas na solução são íons, por exemplo, o sal comum cloreto de sódio (NaCl), formado pelos íons Na+ e Cl-.
Coeficiente de solubilidade
Representa a capacidade máxima do soluto de se dissolver em uma determinada quantidade de solvente. Isso conforme as condições de temperatura e pressão.
• Soluções diluídas: a quantidade de soluto é menor em relação ao solvente.
• Soluções concentradas: a quantidade de soluto é maior que a de solvente.
Fórmulas
Para calcular o coeficiente de solubilidade e concentração de soluções é utilizada as respectivas fórmula:
cs = 100 * m1 / m2
c = m / V