Mapa Mental sobre Propriedades Coligativas e Pressão de Vapor
Transcrição do Mapa Mental sobre Propriedades Coligativas
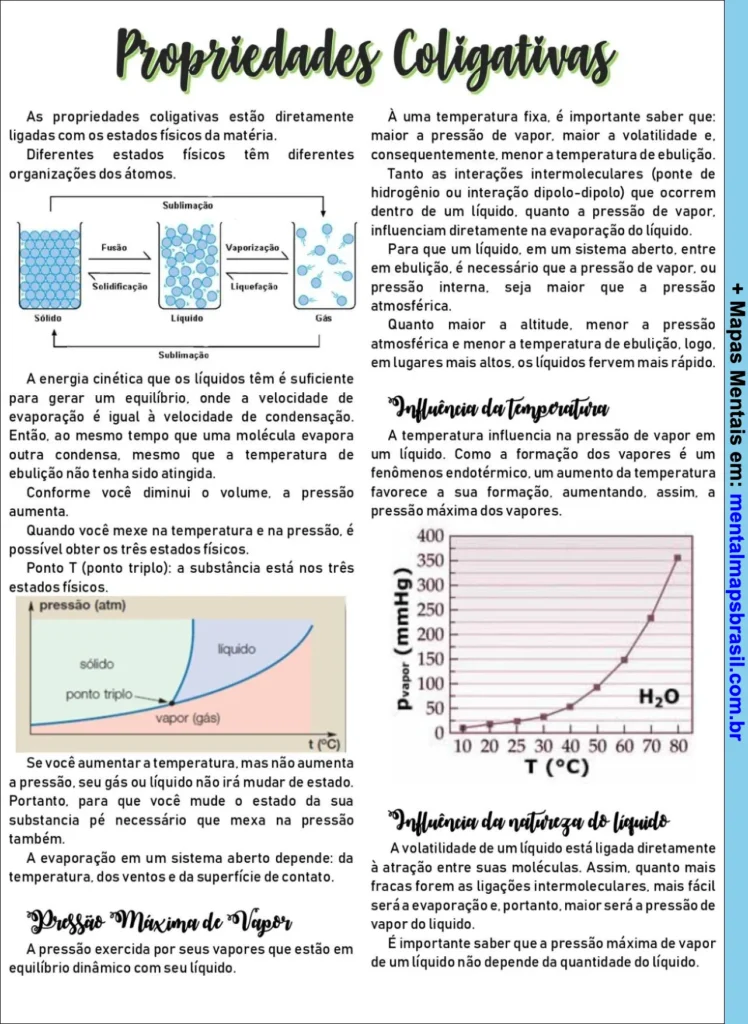
As propriedades coligativas estão diretamente ligadas com os estados físicos da matéria.
Diferentes estados físicos têm diferentes organizações dos átomos.
Subgráficos sobre estados físicos: Sublimação, Fusão, Vaporização, Solidificação, Liquefação.
Continue lendo…
A energia cinética que os líquidos têm é suficiente para gerar um equilíbrio, onde a velocidade de evaporação é igual à velocidade de condensação. Então, ao mesmo tempo que uma molécula evapora, outra condensa, mesmo que a temperatura de ebulição não tenha sido atingida.
Conforme você diminui o volume, a pressão aumenta.
Quando você mexe na temperatura e na pressão, é possível obter os três estados físicos.
Ponto T (ponto triplo): a substância está nos três estados físicos.
Gráfico: temperatura e pressão
Se você aumenta a temperatura, mas não aumenta a pressão, seu gás ou líquido não irá mudar de estado.
Portanto, para que você mude o estado da sua substância, é necessário que mexa na pressão também.
A evaporação em um sistema aberto depende da temperatura, dos ventos e da superfície de contato.
Pressão Máxima de Vapor
A pressão exercida por seus vapores que estão em equilíbrio dinâmico com seu líquido.
Influência da Temperatura
A temperatura influencia na pressão de vapor em um líquido. Como a formação dos vapores é um fenômeno endotérmico, um aumento da temperatura favorece a sua formação, aumentando, assim, a pressão máxima dos vapores.
Influência da Natureza do Líquido
A volatilidade de um líquido está ligada diretamente à atração entre suas moléculas. Assim, quanto mais fracas forem as ligações intermoleculares, mais fácil será a evaporação e, portanto, maior será a pressão de vapor do líquido.
É importante saber que a pressão máxima de vapor de um líquido não depende da quantidade do líquido.