Mapa Mental sobre Gases: Transformações e Leis Fundamentais

Transcrição do Mapa Mental sobre Gases
Estado gasoso
distanciamento entre as moléculas
Variáveis: volume
pressão
temperatura
quantidade de matéria
Volume (v)
Ocupa todo o volume do recipiente
Equação de Clapeyron
P. v= n. R. T
Gás ideal
movimento contínuo e desordenado
Continue lendo…
Equação Geral
P₁V₁/T₁ = P₂V₂/T₂
Transformações gasosas
ISOBÁRICA (p₁ = p₂): V₁/T₁ = V₂/T₂ – lei de Charles e Gay-Lussac
ISOCÓRICA (V₁ = V₂): P₁/T₁ = P₂/T₂ – lei de Charles e Gay-Lussac
ISOTÉRMICA (T₁ = T₂): P₁V₁ = P₂V₂ – lei de Boyle
Temperatura (T em Kelvin)
Grau de agitação das partículas
Tk = Tc + 273
pressão (P)
resulta do choque das partículas de gás com as paredes do recipiente
quantidade de matéria
unidade: mol
6,02. 10²³ moléculas
Mapa Mental sobre Gases Perfeitos com Equação de Clapeyron e Lei de Graham.
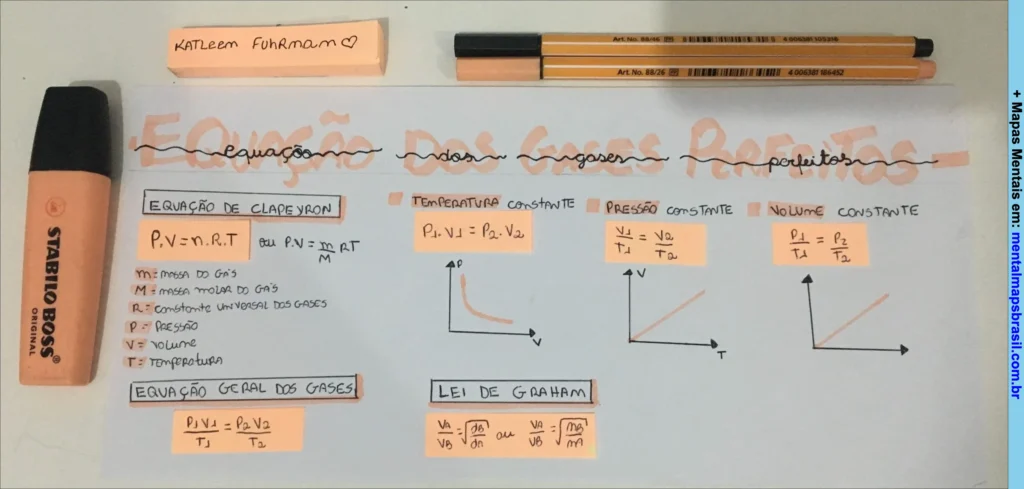
Transcrição do Mapa Mental sobre Equação dos Gases Perfeitos
Equação de Clapeyron
- P.V = n.R.T
- Ou P.V = m/M . R.T
Significados:
- m: massa do gás
- M: massa molar do gás
- R: constante universal dos gases
- P: pressão
- V: volume
- T: temperatura
Equação Geral dos Gases
- P1.V1/T1 = P2.V2/T2
Continue lendo…
Temperatura constante
P1.V1 = P2.V2
Pressão constante
V1/T1 = V2/T2
Volume constante
P1/T1 = P2/T2
Lei de Graham
V.A/V.B = √dB/dA ou V.A/V.B = √M.B/M.A
Mapa Mental sobre Gases Ideais e Equações Clássicas
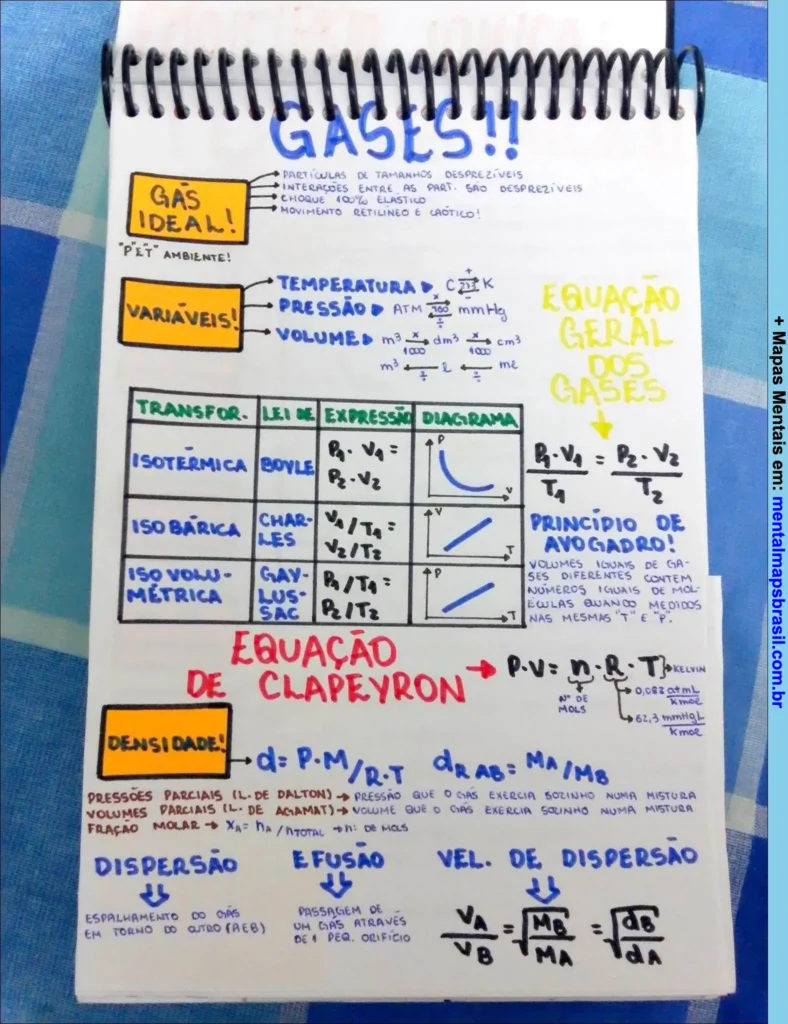
Transcrição do Mapa Mental sobre GASES!!
- Gás Ideal!
Partículas de tamanhos desprezíveis.
Interações entre as partículas são desprezíveis.
Colisão 100% elástica.
Movimento retilíneo e caótico.
“P&T ambiente!” - Variáveis!
Temperatura → °C ⇒ K
Pressão → atm, mmHg
Volume → m³, dm³, cm³, litro
Continue lendo…
Equação Geral dos Gases
- Transferência / Lei / Expressão / Diagrama
- Isotérmica / Boyle / P₁V₁ = P₂V₂
- Isobárica / Charles / V₁/T₁ = V₂/T₂
- Isovolumétrica / Gay-Lussac / P₁/T₁ = P₂/T₂
Princípio de Avogadro
Volumes iguais de gases diferentes contêm números iguais de moléculas quando medidos nas mesmas “T” e “P”.
Equação de Clapeyron
P·V = n·R·T
R = 0,082 atm·L/mol·K
R = 62,3 mmHg·L/mol·K
- Densidade!
d = P·M/R·T
dªb = MA/MB
Dispersão → Espalhamento do gás em torno do outro (A →B).
Efusão → Passagem de um gás através de pequeno orifício.
Vel. de dispersão: √(MA/MB)