Mapa Mental sobre Equilíbrio Químico com Fatores e Constantes.
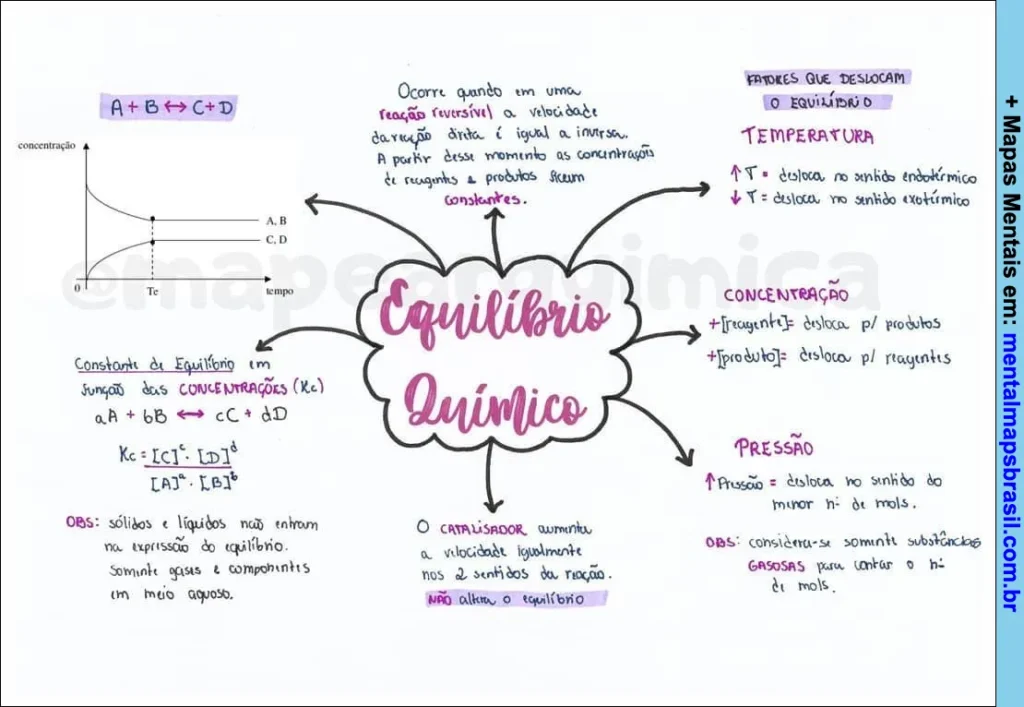
Transcrição do Mapa Mental sobre Equilíbrio Químico
- Ocorre quando em uma reação reversível a velocidade da reação direta é igual à inversa.
- A partir desse momento, as concentrações de reagentes e produtos se tornam constantes.
Constante de Equilíbrio em função das Concentrações (Kc)
- aA + bB ⇌ cC + dD
- Kc = [C]c.[D]d / [A]a.[B]b
Observação:
- Sólidos e líquidos não entram na expressão do equilíbrio.
- Somente gases e componentes em meio aquoso.
Continue lendo…
Fatores que Deslocam o Equilíbrio
Temperatura
- Aumento da T: desloca no sentido endotérmico.
- Diminuição da T: desloca no sentido exotérmico.
Concentração
- Reagente: desloca para os produtos.
- Produto: desloca para os reagentes.
Pressão
- Pressão: desloca no sentido do menor número de mols.
Observação:
- Considera-se somente substâncias gasosas para contar o número de mols.
O Catalisador
- Aumenta a velocidade igualmente nos dois sentidos da reação.
- Não altera o equilíbrio.
Mapa Mental sobre Equilíbrio Químico e suas Variáveis.
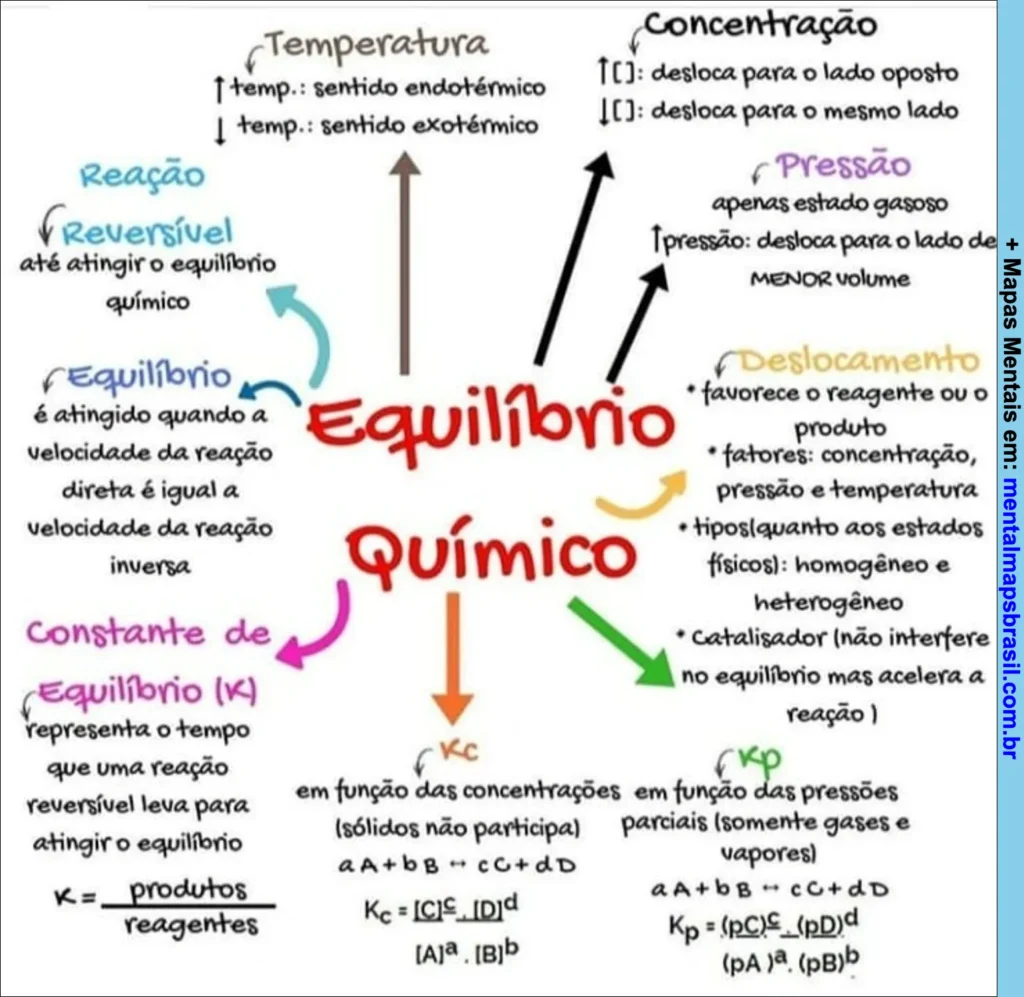
Transcrição do Mapa Mental sobre Equilíbrio Químico
Temperatura
- ↑ temp.: sentido endotérmico
- ↓ temp.: sentido exotérmico
Concentração
- ↑ [C]: desloca para o lado oposto
- ↓ [C]: desloca para o mesmo lado
Pressão
- Apenas estado gasoso
- ↑ pressão: desloca para o lado de menor volume
Continue lendo…
Deslocamento
- Favorece o reagente ou o produto
- Fatores: concentração, pressão e temperatura
- Tipos quanto aos estados físicos: homogêneo e heterogêneo
- Catalisador (não interfere no equilíbrio, mas acelera a reação)
Reação Reversível
- Até atingir o equilíbrio químico
Equilíbrio
- É atingido quando a velocidade da reação direta é igual à velocidade da reação inversa
Constante de Equilíbrio (K)
- Representa o tempo que uma reação reversível leva para atingir o equilíbrio
- K = produtos / reagentes
Kc
- Em função das concentrações (sólidos não participam)
- aA + bB ⇌ cC + dD
- Kc = [C]ᶜ [D]ᵈ / [A]ᵃ [B]ᵇ
Kp
- Em função das pressões parciais (somente gases e vapores)
- aA + bB ⇌ cC + dD
- Kp = (pC)ᶜ (pD)ᵈ / (pA)ᵃ (pB)ᵇ