Mapa Mental sobre Cinética Química: Velocidade das Reações
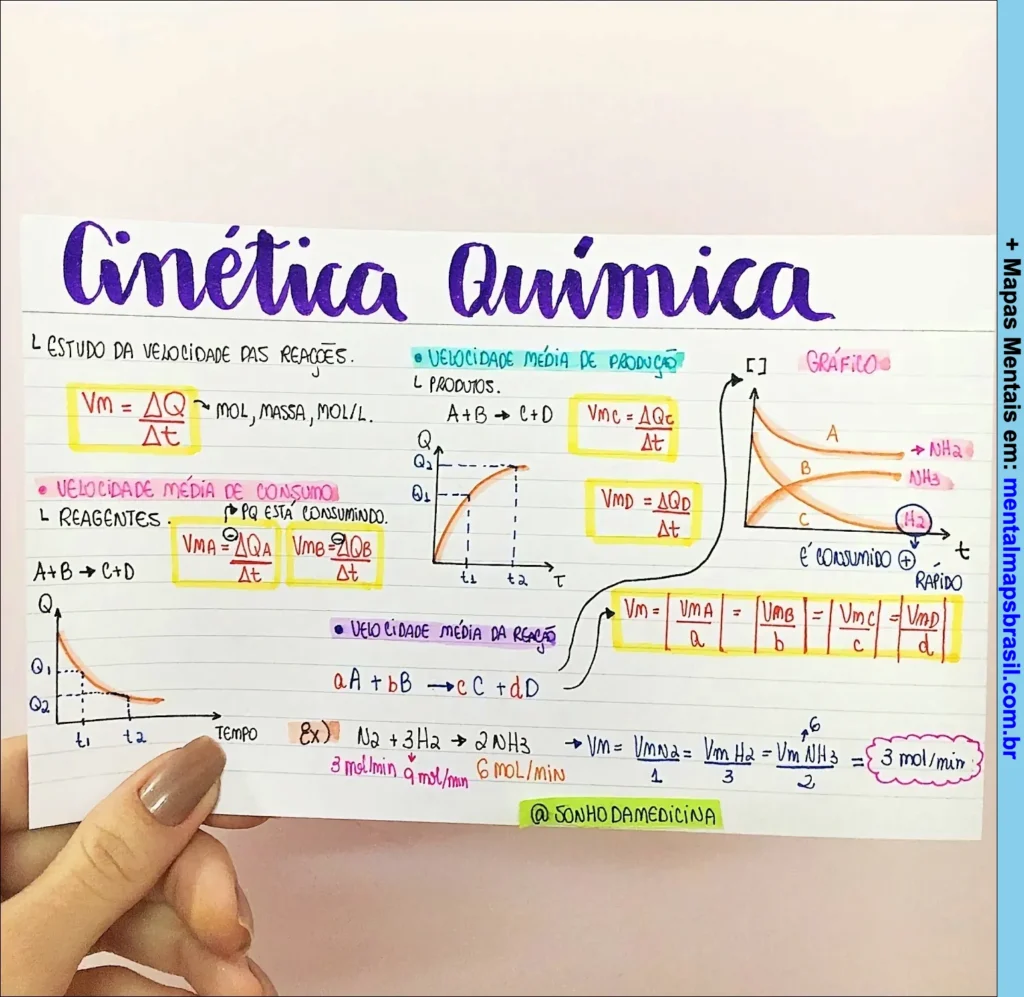
Transcrição do Mapa Mental sobre CINÉTICA QUÍMICA
Estudo da velocidade das reações.
Vm = ΔQ/Δt – mol, massa, mol/L
VELOCIDADE MÉDIA DE CONSUMO
Reagentes: PQ está consumindo
A+B → C+D
VmA = -ΔQA/Δt
VmB = -ΔQB/Δt
Continue lendo…
VELOCIDADE MÉDIA DE PRODUÇÃO
Produtos
A+B → C+D
Vmc = ΔQc/Δt
VmD = ΔQD/Δt
VELOCIDADE MÉDIA DA REAÇÃO
aA + bB → cC + dD
Vm = |VmA/a| = |VmB/b| = |VmC/c| = |VmD/d|
EX:
N2 + 3H2 → 2NH3
2 mol/min 6 mol/min 4 mol/min
Vm = |VmN2/1| = |VmH2/3| = |VmNH3/2| = 2 mol/min
Mapa Mental sobre Cinética Química: Fatores e Mecanismos de Reação

Transcrição do Mapa Mental sobre CINÉTICA QUÍMICA
O QUE É?
• É o ramo da química que estuda a rapidez das reações químicas, bem como os fatores que a influenciam
• A velocidade de uma reação química a variação da quantidade de reagentes e produtos com o passar do tempo
VELOCIDADE MÉDIA DE CONSUMO
Vmédia de consumo de X = Δ[X]/Δt
VELOCIDADE MÉDIA DE FORMAÇÃO
Vmédia de formação de Z = Δ[Z]/Δt
VELOCIDADE MÉDIA DA REAÇÃO
Continue lendo…
Vmédia da reação = -Δ[X]/a·Δt = -Δ[Y]/b·Δt = -Δ[Z]/c·Δt = -Δ[W]/d·Δt
ENERGIA DE ATIVAÇÃO
• É a energia mínima necessária para que a reação possa ocorrer
• Os reagentes e os produtos passam por uma configuração intermediária que recebe o nome de complexo ativado
• Teoria da colisão: a reação química é constituída por colisões entre as moléculas dos reagentes
FATORES QUE INFLUENCIAM A VELOCIDADE DA REAÇÃO
• Concentração: quanto maior, maior a velocidade
• Energia de ativação: quanto maior, menor a velocidade
• Temperatura: quanto maior, maior a velocidade
• Pressão: quanto maior, maior a velocidade
• Superfície de contato: quanto maior, maior a velocidade
• Catálise: é uma reação na qual existe a presença de uma substância capaz de acelerar a reação – um catalisador -, mas que não toma parte na reação propriamente dita, permanecendo inalterada sua massa e suas propriedades após a reação. Seu efeito baseia-se na redução da energia de ativação (caso haja um inibidor – substância que inibe a ação do catalisador – a velocidade será nula)
LEI CINÉTICA DE UMA REAÇÃO
• Permite calcular a velocidade de uma reação a partir das concentrações de reagentes
• V = k.[X]m.[Y]n
• K: constante de velocidade da reação, dependente da temperatura
• [X] e [Y]: concentração dos reagentes X e Y em mol/L
• m: ordem da reação em relação a X
• N: ordem da reação em relação a Y
• m + N: ordem total da reação
MECANISMOS DAS REAÇÕES
• É o conjunto de etapas em que ocorre uma reação, sendo a velocidade da reação determinada pela etapa mais lenta
• reação elementar: uma etapa
• reação não-elementar: duas ou maior etapas
• v = k.[X]x.[Y]y
• x e y são os números de moléculas, respectivamente, de X e Y que sofrem na colisão que provocará a reação
Mapa Mental sobre Cinética Química e Velocidade das Reações
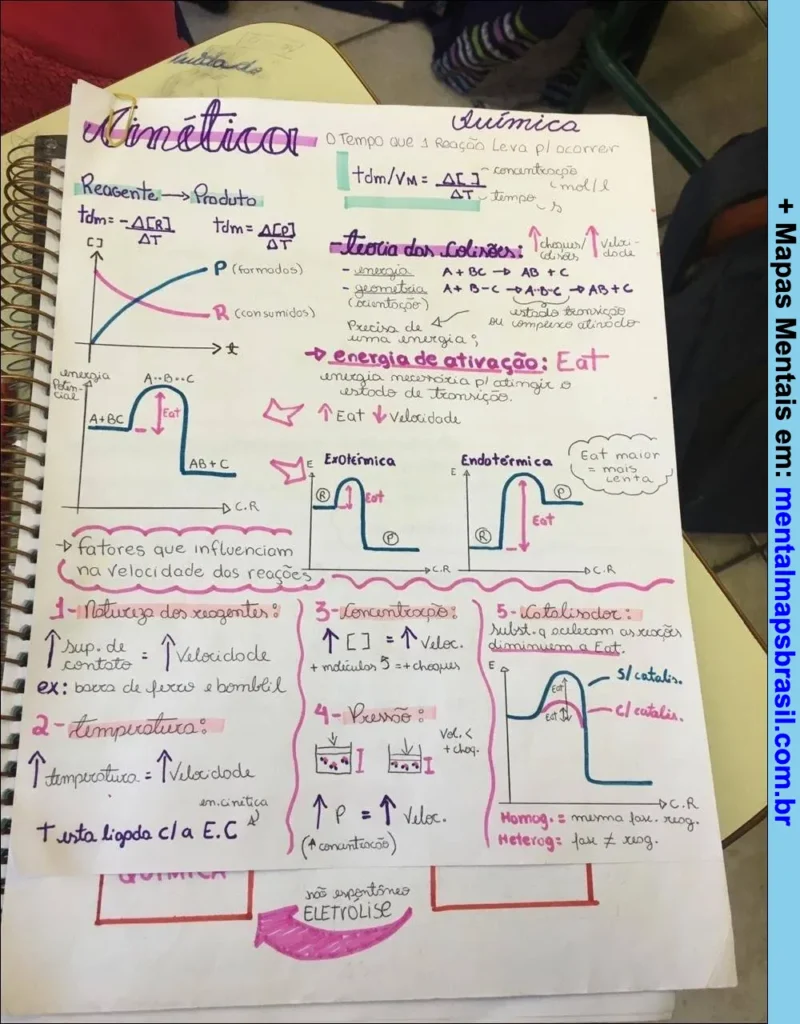
Transcrição do Mapa Mental sobre Cinética Química
- O Tempo que a Reação Leva p/ ocorrer:
tdm ou vm = Δ[ ] / Δt
Teoria dos Colisores
- Energia
- Geometria (orientação)
- Precisão da energia mínima.
Energia de Ativação (Eat)
- Energia necessária p/ atingir o estado de transição.
Reações Endotérmicas e Exotérmicas
- Ex.: Eat maior → mais lenta.
Continue lendo…
Fatores que influenciam a velocidade das reações:
- 1. Natureza dos reagentes
- Sup. de contato: ↑ Velocidade
- Ex.: base de ferro x bomba H.
- 2. Temperatura
- Temperatura ↑ Velocidade
- ΔT está ligado c/ a E.C.
- 3. Concentração
- ↑ [ ] → ↑ Veloc.
- ↑ moléculas → ↑ choques.
- 4. Pressão
- Vol. ↓ → ↑ choques.
- P ↑ → ↑ Veloc.
- 5. Catalisador
- Subst. que acelera ou diminui a Eat.
- Homog.: mesma fase da reação.
- Heterog.: fase ≠ da reação.
Mapa Mental sobre Cinética Química e Energia de Ativação
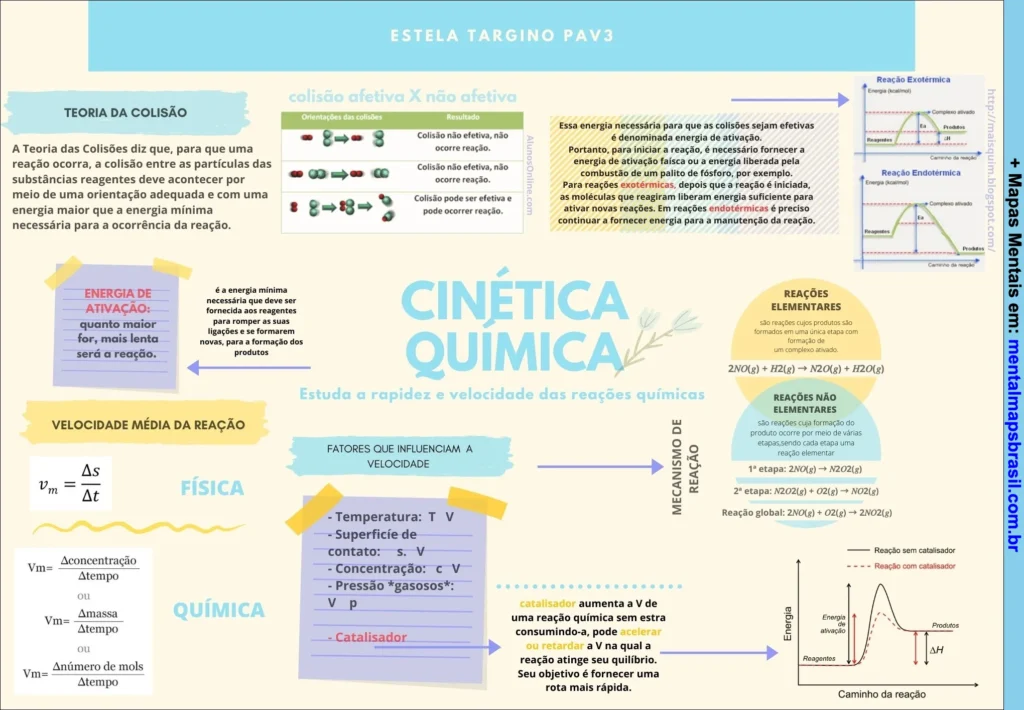
Transcrição do Mapa Mental sobre Cinética Química
- Estuda a rapidez e velocidade das reações químicas.
Teoria da Colisão
- A Teoria das Colisões diz que, para que uma reação ocorra, a colisão entre as partículas das substâncias reagentes deve acontecer por meio de uma orientação adequada e com uma energia maior que a energia mínima necessária para a ocorrência da reação.
Colisão Afetiva X Não Afetiva
- Colisão não efetiva, não ocorre reação.
- Colisão efetiva, pode ocorrer reação.
Continue lendo…
Energia de Ativação:
- É a energia mínima necessária que deve ser fornecida aos reagentes para romper as suas ligações e se formarem novas, para a formação dos produtos.
Velocidade Média da Reação
- Vm = Δs / Δt
Ou: - Vm = Concentração / Δtempo
- Vm = Massa / Δtempo
- Vm = Número de mols / Δtempo
Fatores que influenciam a velocidade:
- Temperatura: T ↑
- Superfície de contato: S ↑
- Concentração: C ↑
- Pressão “gases”: P ↑
- Catalisador: Catalisador aumenta a V de uma reação química sem estar consumindo-a, pode acelerar ou retardar a V na qual a reação atinge seu equilíbrio. Seu objetivo é fornecer uma rota mais rápida.
Reações Elementares
- São reações cujo produtos são formados em uma única etapa com formação do complexo ativado.
Ex.: 2NO₂ + H₂(g) → N₂O(g) + H₂O(g).
Reações Não Elementares
- São reações cuja formação do produto ocorre por meio de várias etapas, sendo cada etapa uma reação elementar.
Ex.:- 1ª etapa: 2NO₂(g) → 2NO(g) + O₂(g).
- 2ª etapa: 2NO(g) + O₂ → 2NO₂(g).
- Reação global: 2NO₂(g) → 2O₂(g).