Mapa Mental sobre Conceitos Básicos de Termoquímica

Transcrição do Mapa Mental sobre TERMOQUÍMICA
TERMOQUÍMICA É O ESTUDO DAS QUANTIDADES DE CALOR LIBERADAS OU ABSORVIDAS DURANTE AS REAÇÕES QUÍMICAS
NÃO CONFUNDIR!
A QUANTIDADE DE + TEMPERATURA = CALOR
UNIDADES DE MEDIDA
SI = JOULE (J)
KCAL = 4,184 J
Continue lendo…
MUDANÇAS DE ESTADO FÍSICO
SÓLIDO → LÍQUIDO → GÁS
ABSORÇÃO DE CALOR LIBERAÇÃO DE CALOR
A VARIAÇÃO DE ENTALPIA (ΔH) É A MEDIDA DA QUANTIDADE DE CALOR LIBERADA OU ABSORVIDA NUMA REAÇÃO, A PRESSÃO CONSTANTE
FATORES QUE INFLUENCIAM NAS REAÇÕES:
O ESTADO FÍSICO DOS REAGENTES E PRODUTOS
A FORMA ALOTROPICA DOS REAGENTES
OS PRODUTOS DA REAÇÃO
O FATO DE ESTAREM OU NÃO EM SOLUÇÃO
A MEDIDA DA QUANTIDADE DE CALOR:
ΔH > 0 (REAÇÃO ENDOTÉRMICA): ABSORVE CALOR
ΔH < 0 (REAÇÃO EXOTÉRMICA): LIBERA CALOR
Mapa Mental sobre Termoquímica com Reações e Entalpia
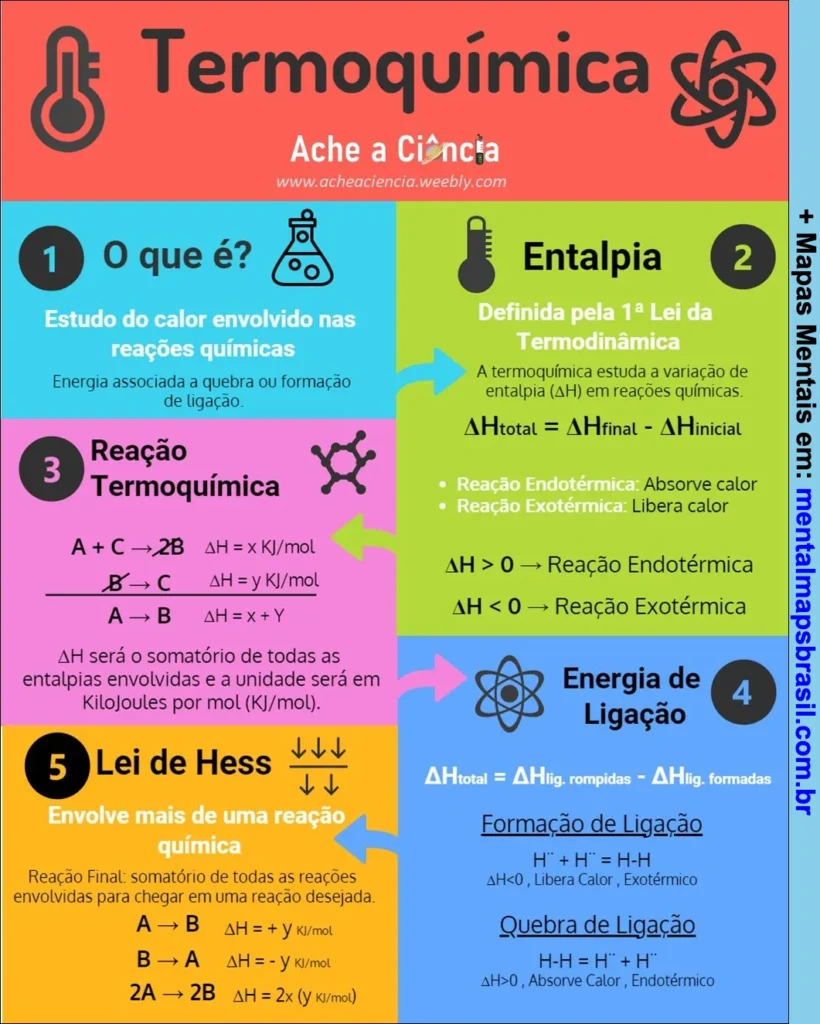
Transcrição do Mapa Mental sobre Termoquímica
1. O que é?
Estudo do calor envolvido nas reações químicas.
Energia associada à quebra ou formação de ligação.
2. Entalpia
Definida pela 1ª Lei da Termodinâmica.
A termoquímica estuda a variação de entalpia (ΔH) em reações químicas.
ΔHtotal = ΔHfinal – ΔHinicial
Reação Endotérmica: Absorve calor
Reação Exotérmica: Libera calor
ΔH > 0 → Reação Endotérmica
ΔH < 0 → Reação Exotérmica
Continue lendo…
3. Reação Termoquímica
A + C → 2B ΔH = x kJ/mol
B → C ΔH = y kJ/mol
A → B ΔH = x + y
ΔH será o somatório de todas as entalpias envolvidas e a unidade será em Kilojoules por mol (kJ/mol).
4. Energia de Ligação
ΔHtotal = ΔHlig. rompidas – ΔHlig. formadas
- Formação de Ligação
H⁺ + H⁻ = H-H
ΔH<0, Libera Calor, Exotérmico - Quebra de Ligação
H-H = H⁺ + H⁻
ΔH>0, Absorve Calor, Endotérmico
5. Lei de Hess
Envolve mais de uma reação química.
Reação Final: somatório de todas as reações envolvidas para chegar em uma reação desejada.
A → B ΔH = x + y kJ/mol
B → A ΔH = y kJ/mol
A → 2B ΔH = 2x (y kJ/mol)
Mapa Mental sobre Termoquímica e Entalpia

Transcrição do Mapa Mental sobre Termoquímica
Troca de calor nas reações químicas.
- Absorção de calor.
- Sólido, líquido, gasoso.
- Liberação de calor.
Exotérmica
Liberação de calor.
- Entalpia (H): ΔH < 0.
Endotérmica
Absorção de calor.
- Entalpia (H): ΔH > 0.
Continue lendo…
Reação química
Lei de Hess
Variação de entalpia de uma reação química depende apenas dos estados inicial e final da reação.
ΔH = Hp – Hr
Entalpia
- Formação:
Energia da reação quando forma 1 mol de substância a partir das substâncias químicas em estado padrão.
Substância simples: ΔH = 0. - Combustão:
Calor liberado na reação de combustão de 1 mol de uma substância em presença de gás oxigênio O₂.
Sempre exotérmica: ΔH < 0. - Neutralização:
Neutralização de 1 mol de H⁺ do ácido por 1 mol de OH⁻ da base (todos em diluição total).
ΔH é entre a base formada e o sal.
Energia armazenada (H):
- 1 cal = 4,18 J.
- Estado padrão: 25°C e 1 atm.
Ligação:
Variação de entalpia no quebra de 1 mol de uma determinada ligação química (todos em estado gasoso) no estado padrão.
- Reagentes: endotérmico (+).
- Produtos: sempre são formados: exotérmico (-).
Dissolução:
Dissolução de uma determinada quantidade de soluto sólido diluído em solução.
- Quebra (endotérmico): interações do soluto.
- Interação soluto com água (exotérmico).
ΔH(dis) = ΔH₁ + ΔH₂.
Mapa Mental sobre Termoquímica com Reações Químicas e Lei de Hess

Transcrição do Mapa Mental sobre Termoquímica
É o calor envolvido em reações químicas.
Reações químicas
- Exotérmica: Libera calor. Ex: fogueiras.
- Endotérmica: Absorve calor.
A variação da energia, a energia que é liberada ou absorvida, é chamada de entalpia ou ΔH.
Continue lendo…
Equações termoquímicas
- Calor de formação: É o calor envolvido na formação de 1 mol de substância química a partir de substâncias simples. O valor de entalpia é zero para as substâncias simples no estado padrão.
Exemplo: Queremos descobrir a entalpia de 18 gramas de água, que corresponde a 1 mol, pois sua massa molar é de 18 g/mol.
Precisamos primeiro da reação de formação da água a partir de substâncias simples, conforme mostrado abaixo:
H₂ (g) + ½ O₂ (g) → H₂O (l) ΔH = -286 kJ/mol
O valor da variação da entalpia que houve nessa reação foi determinado experimentalmente por meio de um calorímetro e é igual a -286 kJ/mol.
A fórmula que calcula essa variação de entalpia (ΔH) é:
ΔH = ∑ Produtos – ∑ Reagentes
O valor da entalpia de 1 mol de água é igual à variação de entalpia da reação de formação, já que ela é o único produto dessa reação:
-286 kJ/mol = H₂O – (H₂ + ½ O₂)
-286 kJ/mol = H₂O
ΔH = -286 kJ/mol
- Calor de combustão: É o calor liberado na queima de 1 mol de uma substância química. É o calor liberado, então o sinal é sempre negativo.
- Calor de dissolução: É o calor envolvido na dissolução de 1 mol de uma substância num dado solvente. É mantida a ação do solvente não cause efeito térmico considerável.
HCl (g) + H₂O (l) → H₃O⁺ (aq) + Cl⁻ (aq)
ΔH = -18,0 kcal/mol
Lei de Hess
É uma consequência do princípio da conservação da energia e usada para o cálculo da variação da entalpia de reações que não podem ser feitas em laboratório. Calcula-se através da soma das entalpias em cada uma das reações intermediárias, independente do número e tipo das reações.
A fórmula é:
ΔH = ΔH₁ + ΔH₂
Uma vez que esse cálculo considera apenas os valores inicial e final, conclui-se que a energia intermediária não influencia no resultado da sua variação. Trata-se de um caso particular do princípio da conservação de energia, a primeira lei da termodinâmica.
A Lei de Hess pode ser calculada como uma equação matemática. Para isso, é possível realizar as seguintes ações:
- Inverter a reação química, nesse caso o sinal do ΔH também deve ser invertido;
- Multiplicar a equação, o valor do ΔH também deve ser multiplicado;
- Dividir a equação, o valor do ΔH também deve ser dividido.
Exemplo:
2 C (grafite) + 3 H₂ (g) + ½ O₂ (g) → C₂H₆O (l)
Dados do calor de combustão:
C (grafite) → CO₂ (g) ΔH = -394 kJ
H₂ (g) → H₂O (l) ΔH = -286 kJ
C₂H₆O (l) → 2 CO₂ (g) + 3 H₂O (l) ΔH = -1368 kJ
Energia de ligação
É a energia necessária para romper um mol de ligações entre átomos no estado gasoso a 25°C e 1 atm. Quanto maior a energia de ligação, mais difícil será a separação dos átomos. A quebra da ligação é endotérmica e a formação é exotérmica.