Mapa Mental sobre os Estados Físicos da Matéria

Transcrição do Mapa Mental sobre Estados Físicos
Força de Coesão: faz com que as moléculas se aproximem umas das outras.
Força de Repulsão: faz com que as moléculas se afastem umas das outras.
Esses estados de agregação da matéria também são chamados de estados físicos da matéria.
Importante: O volume, a densidade e a forma de um composto, podem variar de acordo com a temperatura.
Continue lendo…
Sólido:
Nesse estado físico da matéria, as moléculas se encontram muito próximas, sendo assim possuem forma fixa, volume fixo e não sofrem compressão. As forças de atração (coesão) predominam neste caso. Um exemplo é um cubo de gelo, as moléculas estão muito próximas e não se deslocam, ao menos que passe por um aquecimento.
Líquido:
Aqui as moléculas estão mais afastadas do que no estado sólido e as forças de repulsão são um pouco maiores. Os elementos que se encontram nesse estado, possuem forma variada, mas volume constante. Além destas características, possuem facilidade de escoamento e adquirem a forma do recipiente que os contém.
Gasoso:
O movimento das moléculas nesse estado é bem maior que no estado líquido ou sólido. As forças de repulsão predominam fazendo com que as substâncias não tenham forma e nem volume constante. Se variarmos a pressão exercida sobre um gás, podemos aumentar ou diminuir o volume dele, sendo assim, pode-se dizer que sofre compressão e expansão facilmente. Os elementos gasosos tomam a forma do recipiente que os contém.
Mapa Mental sobre Estados de Agregação da Matéria e Ligações Moleculares.
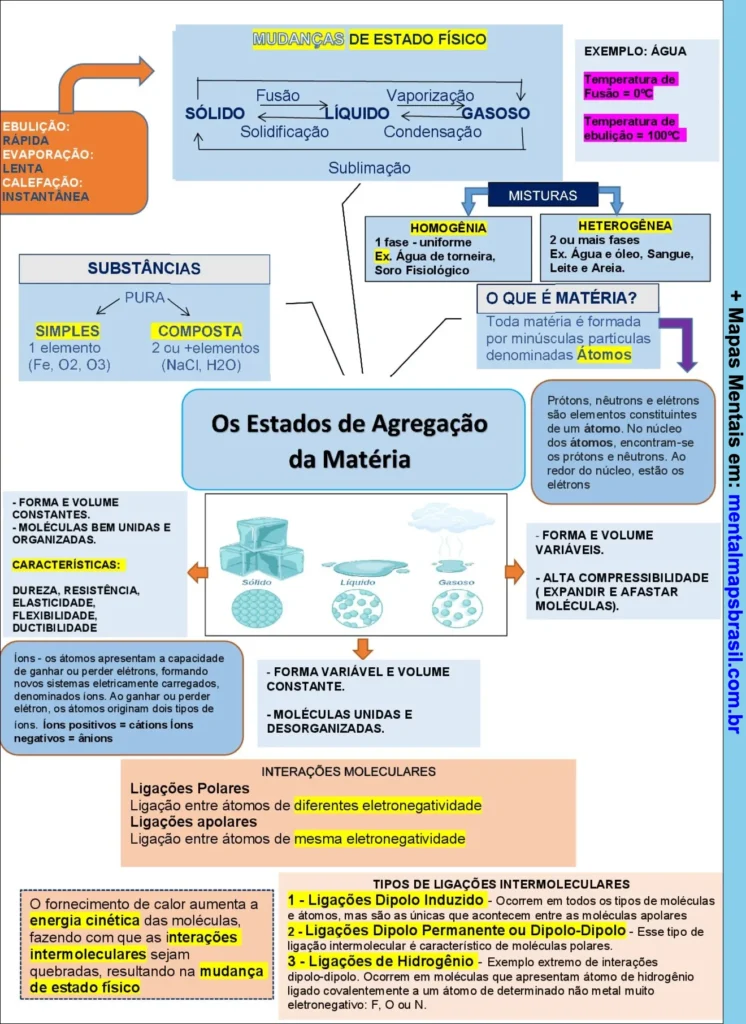
Transcrição do Mapa Mental sobre Os Estados de Agregação da Matéria
- Mudanças de estado físico
- Exemplo: água
- Fusão, Vaporização, Solidificação, Condensação, Sublimação
- Ebulição: rápida
- Evaporação: lenta
- Calefação: instantânea
- Temperatura de fusão = 0°C
- Temperatura de ebulição = 100°C
- Substâncias
- Pura
- Simples: 1 elemento (Fe, O2, O3)
- Composta: 2 ou + elementos (NaCl, H2O)
- Pura
Continue lendo…
- Misturas
- Homogênea: 1 fase – uniforme
- Ex.: Água de torneira, Soro fisiológico
- Heterogênea: 2 ou mais fases
- Ex.: Água e óleo, Sangue, Leite e Areia
- Homogênea: 1 fase – uniforme
- O que é matéria?
- Toda matéria é formada por minúsculas partículas denominadas átomos
- Prótons, nêutrons e elétrons são elementos constituintes de um átomo. No núcleo dos átomos, encontram-se os prótons e nêutrons. Ao redor do núcleo, estão os elétrons
- Características:
- Sólido:
- Forma e volume constantes
- Moléculas bem unidas e organizadas
- Dureza, resistência, elasticidade, flexibilidade, ductibilidade
- Líquido:
- Forma variável e volume constante
- Moléculas unidas e desorganizadas
- Gasoso:
- Forma e volume variáveis
- Alta compressibilidade (expandir e afastar moléculas)
- Sólido:
- Interações moleculares
- Ligações polares: ligação entre átomos de diferentes eletronegatividades
- Ligações apolares: ligação entre átomos de mesma eletronegatividade
- Tipos de ligações intermoleculares
- 1 – Ligações Dipolo Induzido: ocorrem em todos os tipos de moléculas e átomos, mas são as únicas que acontecem entre as moléculas apolares
- 2 – Ligações Dipolo Permanente ou Dipolo-Dipolo: esse tipo de ligação intermolecular é característico de moléculas polares
- 3 – Ligações de Hidrogênio: esse tipo de ligação ocorre entre átomos de hidrogênio ligados covalentemente a um átomo eletronegativo da molécula, como F, O ou N
- O fornecimento de calor aumenta a energia cinética das moléculas, fazendo com que as interações intermoleculares sejam quebradas, resultando na mudança de estado físico
- Misturas