Mapa Mental sobre Substâncias Puras e Misturas com Classificação e Propriedades.
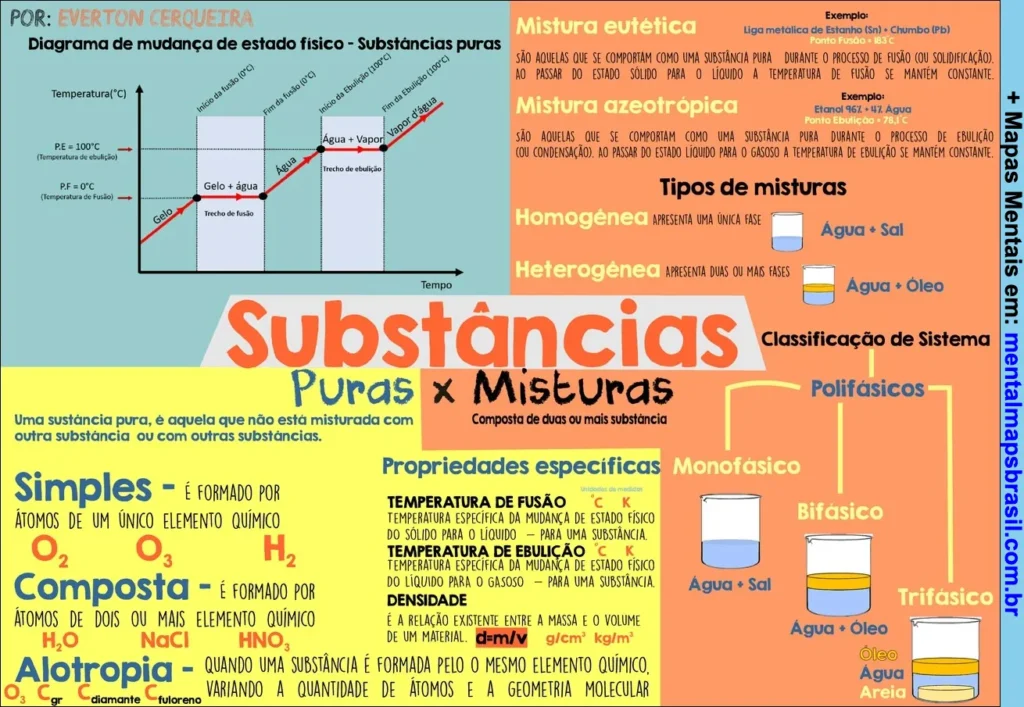
Transcrição do Mapa Mental sobre Substâncias Puras x Misturas
Diagrama de mudança de estado físico – Substâncias puras
P.E. = 100°C (Temperatura de ebulição)
P.F. = 0°C (Temperatura de fusão)
Gelo → Gelo + água → Água → Água + vapor → Vapor
Substâncias Puras x Misturas
Composta de duas ou mais substâncias.
Uma substância pura é aquela que não está misturada com outra substância ou com outras substâncias.
Continue lendo…
Simples
É formada por átomos de um único elemento químico.
Exemplos: O₂, O₃, H₂ Composta
É formada por átomos de dois ou mais elementos químicos.
Exemplos: H₂O, NaCl, HNO₃ Alotropia
Quando uma substância é formada pelo mesmo elemento químico, variando a quantidade de átomos e a geometria molecular.
Exemplos: O₂, O₃, grafite, diamante, fulereno. Mistura eutética
Se comporta como uma substância pura ao passar do estado sólido para o líquido.
Exemplo: Liga metálica de estanho (Sn) e chumbo (Pb) – Ponto de fusão = 183°C. Mistura azeotrópica
Se comporta como uma substância pura ao passar do estado líquido para o gasoso.
Exemplo: Etanol 96% + H₂O – Ponto de ebulição = 78,1°C. Tipos de misturas
Homogênea: Apresenta uma única fase.
Exemplo: Água + sal.
Heterogênea: Apresenta duas ou mais fases.
Exemplo: Água + óleo. Classificação de Sistema
Monofásico: Água + sal.
Bifásico: Água + óleo.
Trifásico: Água + óleo + areia. Propriedades específicas
Temperatura de fusão: Temperatura específica da mudança de estado físico do sólido para o líquido – para uma substância.
Temperatura de ebulição: Temperatura específica da mudança de estado físico do líquido para o gasoso – para uma substância.
Densidade: É a relação existente entre a massa e o volume de um material.
Exemplos: d=m/v, g/cm³, kg/m³.
Mapa Mental sobre Misturas Químicas com classificação e propriedades
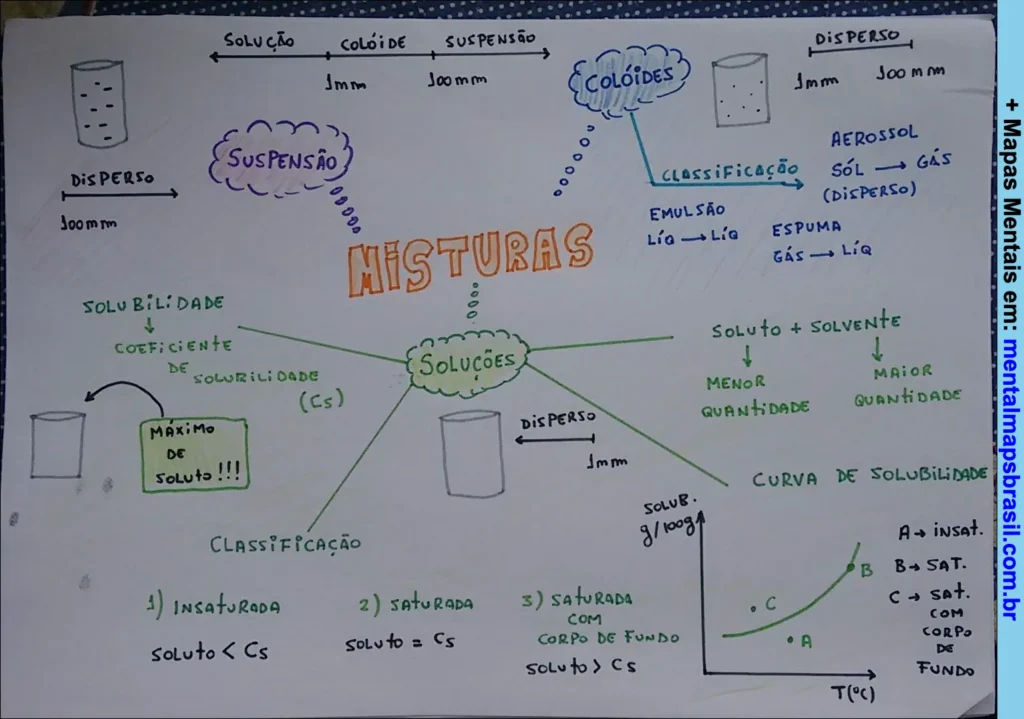
Transcrição do Mapa Mental sobre Misturas
Solução | Coloide | Suspensão
1 mm | 100 nm
Disperso -> 100 nm
Suspensão
Coloides
Classificação
Emulsão
líq → líq
Aerosol
Sól → gás (disperso)
Espuma
Gás → líq
Continue lendo…
Solubilidade
Coeficiente de solubilidade (Cs)
Máximo de soluto!!!
Classificação
- Insaturada
soluto < Cs - Saturada
soluto = Cs - Saturada com corpo de fundo
soluto > Cs
Soluto + solvente
→ menor quantidade
→ maior quantidade
Curva de solubilidade
g/100g
T(°C)
A → insat.
B → sat.
C → sat. com corpo de fundo